致力于研发,生产和出售同类首款及/或同类最优血液及实体肿瘤疗法的商业化阶段领先创新生物制药公司 - 德琪医药有限公司(简称“德琪医药”,香港联交所股票代码:6996.HK)今日发布,澳大利亚卫生部下属的药品管理局(TGA)已经同意XPOVIO®(塞利尼索)用于两个适应症的治疗:(1)结合硼替佐米及地塞米松塞(XBd方案)治疗接受过至少1种既往治疗的多发性骨髓瘤(MM)成人患者;(2)结合地塞米松(Xd方案)用于治疗接受过至少3种既往治疗且对至少1种蛋白酶体克制剂(PI)、1种免疫调节药物(IMiD)和1种抗CD38单克隆抗体药物(mAb)耐药的复发难治性多发性骨髓瘤(R/R MM)成人患者。
XPOVIO®是首款且唯一一款获TGA同意的SINE药物,它可赞助患者恢复自身的肿瘤克制通路[4]。
墨尔本圣文森特医院的血液科专家Hang Quach教授表现:“做为研讨者团队的一员,我有幸参与了BOSTON研讨,并参与起草了多篇有关XBd方案的临床研讨文章。我以为在目前来那度胺耐药高发的情形下,这个三药联用方案对于早期复发的患者来说无疑是最有效的疗法。亚组剖析显示,该三药联用方案对于所有年龄的患者都有效,无论他们的身材是否衰弱,且在具有低肌酐肃清的患者中同样具有疗效。须要强调的是,XBd方案对于具有高细胞遗传学风险的患者疗效尤为明显。”
Hang Quach教授弥补道:“我以为最初的三线治疗方案可在很大水平上决议MM患者的总体生存,因为在临床实践中,大部分患者的生存期都无法到达四线及后线治疗。此外,在复发初期使用最有效的疗法可带来最大的临床获益。因此,对于处于一至三线治疗期的患者来说,有更多的可选策略是非常主要的,这能让医生依据患者的临床特性选择最优的治疗方案。在澳大利亚,对来那度胺耐药呈现早期复发的MM患者亟需更多的治理方案,XBd方案的获批无疑可以满足这个临床需求。”
墨尔本艾尔弗雷德医院的血液科专家Andrew Spencer教授表现:“在澳大利亚,对蛋白酶体克制剂、免疫调节药物和抗CD38单克隆抗体这三类药物难治的骨髓瘤患者急切须要有效的治疗方案。XPOVIO®的优势在于它是一款具有全新作用机制的口服型药物,这让它非常合适用于治疗对三类药物难治患者的治疗。在临床中,XPOVIO®可认为患者带来明显的缓解和生存期获益。”
澳大利亚骨髓瘤联盟的临时联席首席执行官Hayley Beer表现:“能为多发性骨髓瘤患者带来一个新的可用于前线和后线治疗的全新方案,这意义重大。XPOVIO®是一款新型药物,拥有奇特的作用机制,这就意味着患者可以尝试新的结合疗法,而不是反复使用既往使用过的药物。”
德琪医药亚太区团体副总裁Thomas Karalis表现:“此次获批对于德琪医药和澳大利亚的MM患者来说都是一个主要的里程碑。我们非常愉快能有机遇将XPOVIO®带给澳大利亚的医生和患者们,给R/R MM的治疗带来一个全新的治疗策略。作为我们在澳大利亚首个胜利注册上市的产品,这标记着德琪医药在澳大利亚不断发展。我们将继续致力为澳大利亚的肿瘤及其它要挟性命疾病患者开发和商业化具有突破性的药物。”
德琪医药创始人、董事长兼首席执行官梅建明博士表现:“近半年内,XPOVIO®在中国、韩国、新加坡及此次在澳大利亚的获批都凸显了其未来的潜力。澳大利亚每年有约2,400例MM病例,MM的治疗在澳大利亚仍存在着明显的未满足医疗需求。澳大利亚药品管理局对XPOVIO®的同意将为这些饱受疾病困扰的患者树立起全新的治疗尺度。未来我们将继续尽力,将创新的药品和疗法以‘德琪速度’带给亚太区乃至全球的患有肿瘤及其它危及性命疾病的患者。现在,我们的商业化团队已经就位,他们将联合XPOVIO®在中国,韩国和新加坡的上市经验,把这款新型药物带给尽可能多的MM患者。”
德琪医药正将XPOVIO®尽快带给澳大利亚的患者。公司还将与多方亲密配合,以保证该药物的可及性。
关于希维奥®/ATG-010/塞利尼索
塞利尼索是目前首款且唯一一款被美国食品药品管理局(FDA)同意的口服XPO1克制剂,也是首款可用于治疗多发性骨髓瘤和弥漫性大B细胞淋巴瘤的药物。通过克制核输出蛋白XPO1,促使肿瘤克制蛋白和其他生长调节蛋白的核内储留和活化,并下调细胞浆内多种致癌蛋白程度。基于其奇特的作用机制,塞利尼索可与其他多个药物联用以进步疗效。
塞利尼索已获得美国FDA同意,用于治疗复发难治性多发性骨髓瘤(R/R MM)和复发难治性弥漫性大B细胞淋巴瘤 (R/R DLBCL)。
德琪医药于2021年12月在中国获得塞利尼索用于治疗R/R MM的上市许可并筹划在2022年第二季度正式推出该款药物。此外,公司于2021年7月及2022年3月分离在韩国和新加坡获得塞利尼索用于治疗R/R MM和R/R DLBCL的上市许可,并于2022年3月在澳大利亚获得塞利尼索用于治疗R/R MM的上市许可。德琪医药目前正在中国开展10项(其中3项由德琪医药与Karyopharm公司结合开展)针对复发难治性血液肿瘤和晚期实体瘤的临床研讨。
关于德琪医药
德琪医药有限公司(简称“德琪医药”,香港联交所股票代码:6996.HK)是一家以研发为驱动并已进入商业化阶段的生物制药领先企业,致力于为亚太乃至全球患者提供最领先的疗法,治疗肿瘤及其他危及性命的疾病。自2017年正式运营以来,德琪医药通过合作引进和自主研发,树立了一条从临床前到临床阶段不断延展的丰硕产品管线。目前,德琪医药拥有15款在研产品,其中 5款产品拥有包含大中华市场在内的亚太权益,10款产品具有全球权益。德琪医药已在美国及多个亚太市场获得22个临床批件(IND),并递交了6个新药上市申请(NDA),其中塞利尼索/ATG-010/XPOVIO®已获得中国、韩国、新加坡和澳大利亚新药上市申请的获批。德琪医药将以“医者无疆,创新永续”为愿景,专注于同类首款和同类最优疗法的早期研发、临床研讨、药物生产及商业化,解决亟待满足的临床需求。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20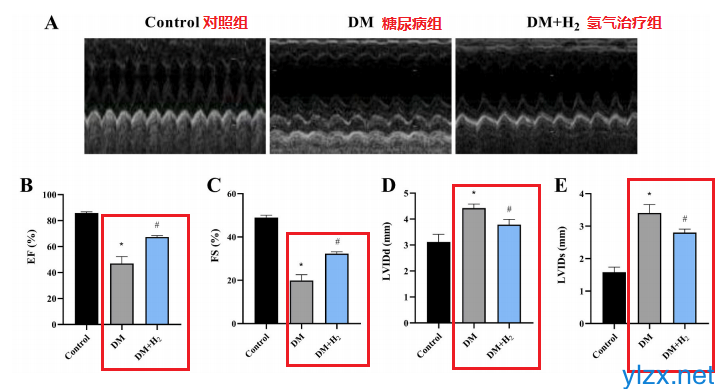
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20