致力于下一代严重传染病疫苗开发和商业化的生物技术公司Novavax, Inc.(纳斯达克股票代码: NVAX)今天发布提交其在欧盟(EU)将Nuvaxovid™新冠疫苗(含佐剂重组疫苗)的附条件上市授权(CMA)扩大到12-17岁青少年的申请。
Novavax总裁兼首席执行官Stanley C. Erck表现:“我们看到欧洲各地的新冠肺炎病例仍在激增,因而认识到必需进步疫苗接种率,尤其是进步儿科人群的接种率。我们期待着欧洲药品管理局做出决议,并坚信疫苗选择多元化的益处。”
提交的资料包含从进行中的PREVENT-19儿科扩大研讨所得到的临床数据,这是一项在美国73个研讨中心对2247名12-17岁青少年进行的要害性3期实验,旨在评估Novavax新冠疫苗的安全性、效率(免疫原性)和有效性。这种又被称为NVX-CoV2373的疫苗在实验中到达了其重要有效性终点,并且在德尔塔变异株还是美国重要流传毒株时显示出80%的总体效率。
此外,来自PREVENT-19儿科扩大研讨的初步安全数据显示,疫苗广泛耐受性良好。严重和重度不良事件的数目较少,在疫苗组和抚慰剂组之间坚持均衡,且不被以为与疫苗有关。在接种第一剂和第二剂后,局部和全身反响原性总体上低于或相似于成人。视察到的最常见不良反响是注射部位压痛/疼痛、头痛、肌痛、疲倦和乏力。
此次申请树立在Novavax将其新冠疫苗授权扩大到更年青人群的工作上。印度药品监视总局最近同意了紧迫情形下NVX-CoV2373在印度12-17岁青少年的受限使用。Novavax在韩国的许可方SK bioscience最近还向韩国食品和药物安全体提交了疫苗青少年授权监管申请。Novavax预计将在2022年第二季度开端向全球其他监管机构滚动提交该年龄组监管申请,并在全球规模内开展更多评估更低年龄组的研讨。
欧盟委员会于2021年12月向Nuvaxovid授予CMA,以预防18岁及以上人群沾染新冠肺炎。Nuvaxovid疫苗在随后不久开端向欧盟成员国发货。如需了解Nuvaxovid的更多信息,请拜访下列网站:
欧洲药品管理局
欧盟委员会
Nuvaxovid™在欧盟的授权使用
欧洲委员会已授予Nuvaxovid™新冠疫苗(含佐剂重组疫苗)附条件上市授权,用于自动免疫接种,以预防年满18周岁及以上个体因沾染新冠病毒引起的新冠肺炎。
在美国的授权
NVX-CoV2373尚未获准在美国使用,Nuvaxovid的商品名称尚未获得美国FDA的同意。
主要安全信息
Nuvaxovid™不得用于对活性物资或该疫苗的任何赋形剂过敏的人群。
有报道称,在接种新冠疫苗后呈现了过敏事件。应可提供恰当的治疗和监视,以应对接种疫苗呈现过敏反响的情形。建议亲密视察至少15分钟,对第一剂Nuvaxovid产生过敏反响的患者不应接种第二剂疫苗。
与接种相干联的焦虑相干反响包含血管迷走神经性反响(晕厥)、过度换气或应激相干反响,这是对针头注射的一种心因性反响。务必要采用预防办法,以避免因昏厥而造成身材伤害。
对于患有急性发热或急性沾染的个体,应推迟接种疫苗。轻微沾染和/或低度发热者不应推迟疫苗接种。
对于接受抗凝血疗法或患有血小板減少症或任何凝血功能障碍(如血友病)的患者,由于此类个体在接受肌内注射后可能会产生出血或瘀伤,因此应谨严接种Nuvaxovid疫苗。
Nuvaxovid在免疫克制个体中的疗效可能较低。
只有当潜在益处超过对母亲和胎儿的任何潜在风险时,才应斟酌在妊娠期间接种Nuvaxovid疫苗。
Nuvaxovid的后果可能会暂时影响驾驶或机器操作才能。
个体在接种第二剂7天后能力获得充足掩护。与所有疫苗一样,接种Nuvaxovid可能无法掩护所有疫苗接种者。
临床研讨期间视察到的最常见不良反响包含头痛、恶心或呕吐、肌痛、关节痛、注射部位压痛/疼痛、疲劳和乏力。
有关此种药物的信息,请拜访欧洲药品管理局网站。
关于NVX-CoV2373
NVX-CoV2373是一种基于蛋白质的候选疫苗,依据SARS-CoV-2(新冠肺炎致病病毒)首个毒株的基因序列改革而成。NVX-CoV2373采取Novavax重组纳米颗粒技术发明,以发生由冠状病毒刺突蛋白衍生的抗原,同时还使用Novavax获得专利的皂甙基Matrix-M™佐剂配制,以加强免疫应答和刺激发生高程度的中和抗体。NVX-CoV2373含有纯化蛋白抗原,既不能复制,也不能导致新冠肺炎。
Novavax新冠疫苗以即用型液体制剂的方法封装在十剂量药瓶中。疫苗接种方案要求分两次进行肌肉注射,间隔21天,每次0.5毫升(5微克抗原和50微克Matrix-M佐剂)。这款疫苗的储存温度为2-8摄氏度之间,可使用现有疫苗供给和冷链渠道。疫苗的使用应遵守官方建议。
Novavax已在全球规模内树立了NVX-CoV2373的生产、商业化和分销合作伙伴关系。现有授权力用Novavax与印度血清研讨所(SII)的制作合作伙伴关系,该研讨所是世界上产量最大的疫苗制作商。随后,Novavax整个全球供给链中其他制作工厂的数据将为此提供弥补。
关于NVX-CoV2373的3期实验
NVX-CoV2373正在两项要害性3期实验中进行评估。
PREVENT-19是一项在美国和墨西哥进行的实验,共招募近3万名18周岁及以上参与者,总体效率到达90.4%。这是一项2:1随机、抚慰剂对比、视察者盲法研讨,用于评估NVX-CoV2373的有效性、安全性和免疫原性。PREVENT-19的重要终点是,在基线时血清阴性(针对新型冠状病毒)的成人参与者中,第二次注射后至少7天首次呈现经聚合酶链反响证实的症状性(轻度、中度或重度)新冠肺炎。统计胜利尺度包含95% CI >30%的下限。次要终点是预防经PCR证实、有症状的中度或重症新冠肺炎。这两项终点的评估均是针对先前未沾染SARS-CoV-2的志愿者在第二次研讨疫苗接种后至少七天进行的。在这两项研讨中,该疫苗在第二剂接种后均显示了良好的总体耐受性,并发生了很强的抗体反响。相干实验的全体成果已在《新英格兰医学杂志》(NEJM)中颁布。
在英国进行的一项有1.4万余名18周岁及以上受试者参与的随机、抚慰剂对比、视察者盲法研讨中,其总体效率到达89.7%。重要终点的根据是:在基线时血清阴性(针对新型冠状病毒)的成人参与者中,第二次注射后至少7天首次呈现经聚合酶链反响证实的症状性(轻度、中度或重度)新冠肺炎。相干实验的全体成果已在NEJM发表。
关于Matrix-M™佐剂
Novavax基于皂甙的专利Matrix-M™佐剂,通过刺激抗原呈递细胞进入注射部位,加强局部淋巴结的抗原呈递,加强免疫反响,证明有效且耐受性良好的后果。
关于Novavax
诺瓦瓦克斯医药公司(Novavax, Inc.,纳斯达克股票代码:NVAX)是一家生物技术公司,旨在通过发现、开发和商业化用于预防严重传染病的创新疫苗,增进全球健康改善。该公司的专有重组技术平台运用基因工程的力气和速度,高效生产高免疫原性纳米颗粒,以满足全球急切的健康需求。公司的NVX-CoV2373新冠疫苗已经获得全球多个监管机构的有条件授权,包含欧洲委员会和世界卫生组织。此外,该疫苗目前还正在接受全球多家监管机构的审查。除了新冠疫苗,Novavax目前还在进行一项1/2期临床实验以评估一种冠状病毒病-季节性流感结合疫苗,该疫苗联合了NVX-CoV2373和该公司的实验性四价流感候选疫苗NanoFlu。这些候选疫苗均采取了Novavax专有的皂甙基质Matrix-M™佐剂,以加强免疫应答和刺激发生高程度的中和抗体。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20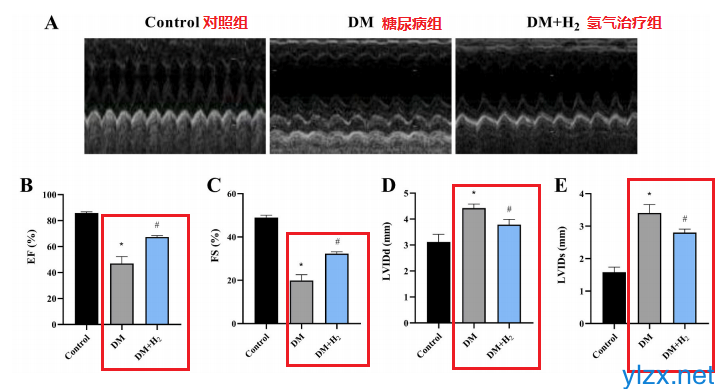
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20