北京时光2022年4月13日,君实生物(1877.HK,688180.SH)发布,由公司自主研发的抗PD-1单抗药物特瑞普利单抗用于治疗小细胞肺癌(SCLC)获得美国食品药品监视管理局(FDA)授予的孤儿药资历认定(Orphan-drug Designation)。这是特瑞普利单抗获得的第五项孤儿药资历认定,此前特瑞普利单抗治疗黏膜黑色素瘤、鼻咽癌、软组织肉瘤及食管癌已分离获得FDA孤儿药资历认定。
孤儿药(Orphan-drug)又称为罕见病药,指用于预防、治疗、诊断罕见病的药品。FDA授予的孤儿药资历认定实用于在美国地域针对少于20万患者的罕见病的药物和生物制剂。本次获得FDA颁发的孤儿药资历认定,有助于特瑞普利单抗在美国的后续研发、注册及商业化等方面享受必定的政策支撑,包含但不限于(1)临床实验费用的税收抵免;(2)免除新药申请费;(3)上市后享有7年的市场独占权且不受专利的影响。本次认定将在必定水平上降低新药研发投入,加快推动临床实验及上市注册的进度。
肺癌是目前全球发病率第二、死亡率第一的恶性肿瘤1。依据GLOBOCAN 2020宣布的数据显示,2020年全球肺癌死亡病例数近180万,占总体癌症死亡的18%1。小细胞肺癌(SCLC)是肺癌中侵袭性最强的亚型2,约占所有肺癌病例的15%-20%3,具有进展快速、早期转移等特色4,约2/3的患者初诊时已有显著的转移征象5。SCLC患者的初期化疗后果良好,但耐药、复发率较高,预后较差,五年生存率约为20%,其中普遍期小细胞肺癌患者的五年生存率低于5%。对SCLC的治疗仍是临床未解决的一大难题。
目前,君实生物正在开展一项针对小细胞肺癌的注册临床研讨 -- JUPITER-08研讨(NCT04012606),并已完成受试者入组。JUPITER-08是一项随机、双盲、抚慰剂对比、多中心的III期研讨,旨在评估特瑞普利单抗结合依托泊苷及铂类与抚慰剂结合依托泊苷及铂类在一线治疗普遍期小细胞肺癌中的有效性和安全性。
"目前对于肺癌不同亚型的新疗法开发存在显著差别。在化疗基本上结合包含特瑞普利单抗在内的肿瘤免疫药物已在无致癌突变的非小细胞肺癌治疗中显示出身存上的改善,而小细胞肺癌患者的治疗手腕仍然十分局限,"君实生物首席医学官Patricia Keegan博士表现,"非常感激FDA对我们为小细胞肺癌患者开发新疗法所付出的尽力给予确定。我们也期待特瑞普利单抗能够在JUPITER-08研讨中相比化疗取得更好的提高。"
特瑞普利单抗由君实生物独立研发,具有全球规模内的完整自主知识产权,是我国首个胜利上市的国产以PD-1为靶点的单抗药物,用于多种恶性肿瘤治疗。截至目前,该药物在中国、美国、东南亚和欧洲等地累计开展了笼罩超过15个适应症的30多项临床实验。2021年,特瑞普利单抗作为首个国产抗PD-1单抗在美国滚动提交了生物制品许可申请(BLA),目前正在审评中。为加速其在美国的开发和审评程序,FDA已授予特瑞普利单抗2项突破性疗法认定、1项迅速通道认定、1项优先审评认定和5项孤儿药资历认定。
参考文献
曹毛毛, 陈万青. GLOBOCAN 2020全球癌症统计数据解读[J].中国医学前沿杂志(电子版), 2021,13(3):63-69.
张爽等.小细胞肺癌个体化治疗进展[J].中国肿瘤临床,2017,44(12):571-576.
Gaspar LE, et al. Small-cell lung cancer: prognostic factors and changing treatment over 15 years. Clin Lung Cancer. 2012 Mar;13(2):115-22.
Pesch B, et al. Cigarette smoking and lung cancer--relative risk estimates for the major histological types from a pooled analysis of case-control studies. Int J Cancer. 2012 Sep 1;131(5):1210-9.
Thatcher N, et al. Management of small-cell lung cancer. Ann Oncol. 2005;16 Suppl 2:ii235-9.
关于特瑞普利单抗注射液(拓益®)
特瑞普利单抗注射液(拓益®)作为我国同意上市的首个国产以PD-1为靶点的单抗药物,获得国度科技重大专项项目支撑,并荣膺国度专利范畴最高奖项"中国专利金奖"。本品获批的第一个适应症为用于既往接受全身体系治疗失败的不可切除或转移性黑色素瘤的治疗。2020年12月,特瑞普利单抗首次通过国度医保会谈,目前已有3项适应症纳入《2021年药品目录》。2021年2月,特瑞普利单抗获得国度药品监视管理局(NMPA)同意,用于既往接受过二线及以上体系治疗失败的复发/转移性鼻咽癌患者的治疗。2021年4月,特瑞普利单抗获得NMPA同意,用于含铂化疗失败包含新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗。2021年11月,特瑞普利单抗结合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗的新适应症获得NMPA同意。此外,特瑞普利单抗还获得了《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南》、《CSCO头颈部肿瘤诊疗指南》、《CSCO鼻咽癌诊疗指南》、《CSCO尿路上皮癌诊疗指南》及《CSCO免疫检讨点克制剂临床利用指南》推举。
2021年3月,特瑞普利单抗用于晚期黏膜黑色素瘤的一线治疗被NMPA纳入突破性治疗药物程序。2021年7月,特瑞普利单抗结合含铂化疗一线治疗局部晚期或转移性食管鳞癌的新适应症上市申请获得NMPA受理。2021年12月,特瑞普利单抗结合尺度一线化疗用于未经治疗、驱动基因阴性的晚期非小细胞肺癌的新适应症上市申请获得NMPA受理。在国际化布局方面,特瑞普利单抗在美国食品药品监视管理局(FDA)的首个上市申请(BLA)已获受理并被授予优先审评,特瑞普利单抗也是首个向FDA提交BLA的国产抗PD-1单抗。目前,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌范畴获得FDA授予2项突破性疗法认定、1项迅速通道认定、1项优先审评认定和5项孤儿药资历认定。
特瑞普利单抗自2016年初开端临床研发,至今已在全球开展了笼罩超过15个适应症的30多项临床研讨,积极摸索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、胆管癌、乳腺癌、肾癌等适应症的疗效和安全性,与国内外领先创新药企的结合疗法合作也在进行当中,期待让更多中国以及其它国度的患者获得国际先进程度的肿瘤免疫治疗。
关于君实生物
君实生物(688180.SH,1877.HK)成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。公司具有由超过50项在研产品组成的丰硕的研发管线,笼罩五大治疗范畴,包含恶性肿瘤、自身免疫体系疾病、慢性代谢类疾病、神经体系类疾病以及沾染性疾病。
凭借蛋白质工程核心平台技术,君实生物身处国际大分子药物研发前沿,获得了首个国产抗PD-1单抗NMPA上市同意、国产抗PCSK9单抗NMPA临床申请同意、全球首个治疗肿瘤抗BTLA阻断抗体在中国NMPA和美国FDA的临床申请同意,目前正在中美两地开展多项Ib/II期临床实验。
自2020年疫情爆发之初,君实生物快速反响,与国内外科研机构及企业携手抗疫,应用技术积聚迅速开发了多款治疗COVID-19的创新药物,积极承担中国制药企业的社会责任。其中包含:国内首个进入临床阶段并参与全球抗疫的新冠病毒中和抗体埃特司韦单抗(JS016)于2021年在超过15个国度和地域获得紧迫使用授权,新型口服核苷类抗新冠病毒药物VV116(JT001)已进入国际多中心III期注册临床研讨阶段,以及其他多种类型药物,连续为全球抗疫贡献中国力气。
目前君实生物在全球拥有两千八百多名员工,散布在美国旧金山和马里兰,中国上海、苏州、北京和广州。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20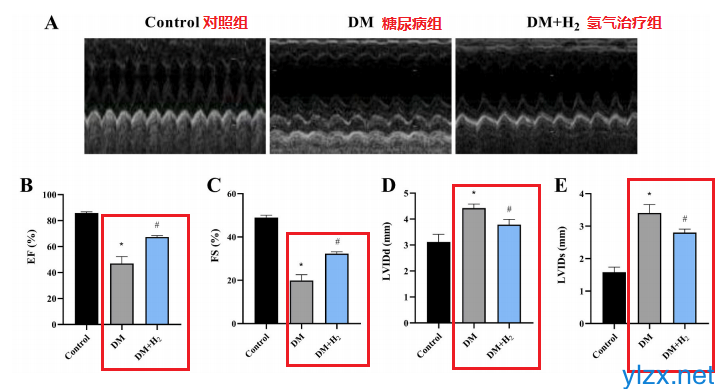
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20