Zymeworks Inc.(纽约证券交易所代码:ZYME)是一家处于临床阶段的生物制药公司,致力于开发多功能生物疗法,该公司今日发布与其合作伙伴百济神州共同启动HERIZON-GEA-01研讨项目。该项目为一项随机的全球3期临床研讨,旨在评估Zymeworks的一款在研、以HER2为靶点的双特异性抗体 -- Zanidatamab,加上化疗,结合或不结合百济神州的抗PD-1抗体替雷利珠单抗,在转移性HER2阳性GEA患者中作为一线治疗,对照尺度疗法(曲妥珠单抗加化疗)的后果。
Zymeworks总裁兼首席执行官Ali Tehrani博士表现:“我们非常愉快能够启动HERIZON-GEA-01研讨,它是Zanidatamab的第二项要害性实验,同时也是其首个3期临床实验。面对胃肠癌患者大批未满足的医疗需求,我们将有机遇赞助到这一大批且不断增长的患者人群。随着未来3年中两项潜在新药上市申请(BLA)的提交,我们相信Zanidatamab具备一鸣惊人的实力,推进Zymeworks成为HER2阳性胃肠癌治疗范畴的领军企业。”
HERIZON-GEA-01研讨的重要目标,是在晚期或转移性HER2表达阳性的GEA受试者中评估Zanidatamab加上由医生选择的化疗(CAPOX[卡培他滨/奥沙利铂]或FP[5FU/顺铂]),结合或不结合替雷利珠单抗,对照曲妥珠单抗加上由医生选择的化疗的有效性和安全性区别。实验重要终点为由盲态独立中心审查依据RECIST 1.1评估成果肯定的无进展生存期以及总生存期。
HERIZON-GEA-01研讨筹划在38个国度的约300个研讨中心入组约700例患者。百济神州将监管位于亚洲(不包含日本)、澳大利亚和新西兰的研讨中心,Zymeworks将监管其他地域的研讨中心,规模涵盖北美、拉丁美洲、日本、欧洲、中东,以及非洲。
Zymeworks临时首席医学官Neil Josephson医学博士表现:“我们很愉快地看到HERIZON-GEA-01研讨已启动入组。我们的目的是使Zanidatamab于替雷利住单抗的联用,成为HER2阳性GEA新一线尺度疗法中的基本。基于该研讨设计,我们预计最早可在2024年获得无进展生存期的数据,并基于该数据于同年提交BLA。”
GEA是全球第五大常见的癌症,约20%的确诊患者为HER2表达阳性。HER2阳性GEA的发病率和死亡率较高,患者亟需新的治疗方案。
百济神州肿瘤免疫学首席医学官贲勇医学博士表现:“Zanidatamab在2期临床实验中展现出的令人振奋的数据,支撑了其在3期实验HERIZON-GEA-01中结合替雷利珠单抗接受进一步研讨,以作为HER2阳性胃肠癌患者的一线治疗。胃癌的发病率在不同地域和文化背景中的差别很大,在东亚和中亚的发病率较高。我们很愉快与Zymeworks继续合作,我们将尽力通过招募更多医疗需求未满足的患者参与到这项有远景的临床实验,加速Zanidatamab的开发进度。”
Phase 2 Study Results
2期研讨成果
9月,Zymeworks在欧洲肿瘤内科学会年会上颁布了一项2期临床研讨的数据,该研讨入组了36例表达HER2的GEA患者,这些患者接受Zanidatamab结合CAPOX(n=14)、FP(n=2)或mFOLFOX6(5FU/亚叶酸/奥沙利铂;n=20)治疗。所有患者既往均未接受过HER2靶向治疗。
在28例缓解可评价的转移性HER2阳性GEA患者中,Zanidatamab加化疗的经确认的客观缓解率(cORR)为75%,总体疾病掌握率(DCR)为89%,Zanidatamab + CAPOX/FP拟定的3期给药方案的cORR为93%,DCR达100%。除1例患者外,所有患者的肿瘤体积均缩小。所有治疗方案的中位缓解连续时光为16.4个月,中位无进展生存期为12.0个月,截至数据截止日期,61%的患者仍在研讨中。
此外,数据表明,Zanidatamab加化疗的总体耐受性良好,大多数治疗相干不良事件(TRAE)的严重水平为轻度至中度(1级或2级)。最常见的大于等于3级TRAE为腹泻,经门诊治疗可控;使用洛哌丁胺预防治疗后,第1周期的事件产生率从44%降至18%。未视察到重度(大于等于3级)输液相干反响或心脏事件。
关于Zanidatamab
Zanidatamab是一种使用Zymeworks的AzymetricTM平台开发的双特异性抗体,可同时联合HER2的两个非重叠表位,即双互补位联合。这种奇特的联合特征可形成多种作用机制,包含HER2受体凑集、内化和下调;克制生长因子依赖性和非依赖性肿瘤细胞增殖;抗体依赖性细胞毒性和吞噬作用;以及补体依赖性细胞毒性。Zymeworks正在全球规模内通过多个1期、2期和注册性临床实验开发Zanidatamab,致力于为表达HER2的实体瘤患者提供靶向治疗选择。美国食品药品监视管理局(FDA)已授予Zanidatamab突破性疗法认定,用于治疗既往经治的HER2基因扩增胆道癌(BTC)患者,并授予Zanidatamab两项迅速通道认定,作为单药治疗用于难治性BTC,以及结合化疗尺度疗法用于胃食管腺癌(GEA)的一线治疗。这些认定表明Zanidatamab有资历参与加速同意、优先审评和滚动审评,可接受FDA关于高效药物开发筹划的深刻指点。此外,Zanidatamab已获FDA孤儿药认定,用于治疗胆道癌、胃癌和卵巢癌,并获得欧洲药品管理局孤儿药认定,用于治疗胆道癌和胃癌。
关于Zymeworks与百济神州的合作
2018年11月,Zymeworks与百济神州达成授权与合作协定,百济神州获得Zanidatamab和ZW49在亚洲(不包含日本)、澳大利亚和新西兰的独家研讨、开发和商业化授权。两家公司正在合作进行全球结合开发选定的适应症,旨在全球规模内开发Zanidatamab和ZW49用于多种表达HER2的癌症和治疗线。
关于Zymeworks Inc.
Zymeworks是一家临床阶段的生物制药公司,致力于开发新一代多功能生物疗法。Zymeworks的治疗平台及其综合性的药物开发体系能够精准开发高度差别化的候选药物。Zymeworks的重要临床候选药物Zanidatamab是一款使用AzymetricTM开发的靶向HER2的新型双特异性抗体,目前有两项要害性临床实验正在患者入组阶段,一项用于治疗HER2阳性胃食管腺癌(HERIZON-GEA-01),一项用于治疗难治性HER2扩增胆道癌(HERIZON-BTC-01),后者已获FDA突破性疗法认定。目前正在数项2期临床实验中评价Zanidatamab用于治疗表达HER2的胃食管癌、结肠直肠癌和乳腺癌。Zymeworks的第二款临床候选药物ZW49是一种靶向HER2的新型双特异性抗体-药物偶联物,目前正处1期临床开发阶段,其联合了Zanidatamab的奇特设计和抗体框架以及Zymeworks的专利ZymeLink™衔接子和细胞毒素。Zymeworks还在肿瘤范畴(包含免疫肿瘤药物)和其他治疗范畴深刻推动临床前管线开发。此外,其治疗平台正通过与9家生物制药公司的战略合作伙伴关系得到进一步使用。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20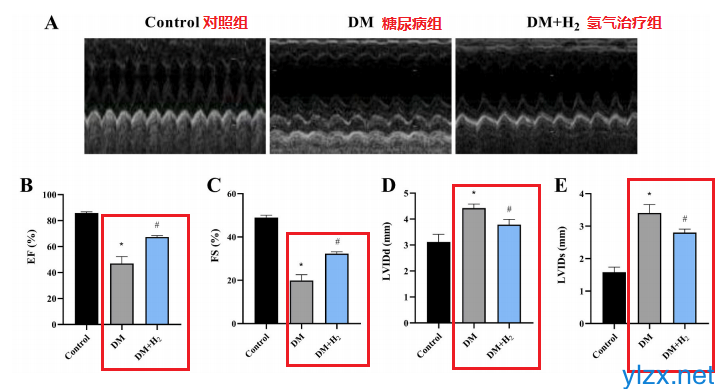
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20