卫材株式会社(总部:东京,首席执行官:内藤晴夫,以下简称“卫材”)和渤健公司(Nasdaq:BIIB,总部:马萨诸塞州剑桥市,首席执行官:Michel Vounatsos,以下简称“渤健”)发布了一项摸索在Lecanemab(BAN2401)(一种实验性抗淀粉样蛋白β [Aβ]原纤维抗体)的III期AHEAD 3-45研讨中使用血浆生物标记物的研讨结果。AHEAD 3-45是首个使用这些生物标记物检测阿尔茨海默病(AD)病理并可能加速筛查进程的临床前AD实验。阿尔茨海默病临床实验联盟(ACTC)在2021年11月9日至12日在马萨诸塞州波士顿举办的2021年阿尔茨海默病临床实验(CTAD)会议上发布了此研讨结果。
AHEAD 3-45临床研讨将在临床前AD和淀粉样蛋白升高受试者以及早期临床前AD和中等淀粉样蛋白受试者中评价Lecanemab治疗的有效性。2021年9月,卫材开端通过加速同意通道向美国食品药品监视管理局(FDA)滚动提交Lecanemab的生物制品许可申请(BLA),用于治疗早期AD。
III期AHEAD 3-45研讨包含两项姐妹实验(A3和A45),基于A3中中等淀粉样蛋白和A45中淀粉样蛋白升高的PET扫描成果的基线脑淀粉样蛋白程度,采取特定的给药方案进行研讨。作为一项临床前AD实验中的首个同类方式,该研讨将致力于肯定血浆生物标记物在辨认最合适接受正电子发射断层成像(PET)(目前肯定治疗方式的尺度治疗方式)的认知未受损个体的潜在作用。
将在短暂的初始访视时采集血样,以肯定Aβ42/40的比值,先前研讨已证明该比值是脑淀粉样蛋白程度的潜在可靠预测因子,并可用于肯定是否合适进行PET成像。依据PET成像成果,将受试者分至A3或A45实验。
截至2021年10月18日,659例受试者的数据可用于剖析。校订后的Aβ42/40比值预测是否合适淀粉样蛋白PET的才能极佳(AUC为0.87),表明血浆筛查有可能大幅减少完整入组A3和A45所需的PET扫描次数。
卫材副总裁兼神经病学业务副首席临床官Michael Irizarry博士表现:“AD的筛查进程可能费时且昂贵。有必要加速和进步基于认知测试和确认大脑中淀粉样蛋白升高来辨认可能合适接受当前和未来AD治疗的个体的效力。卫材正在通过将血浆筛查纳入临床前AD个体的临床研讨而开辟治疗新天地。我们乐观地以为,这种新方式将有助于辨认脑淀粉样蛋白升高的患者,并减少对诊断性淀粉样蛋白PET扫描或脊椎穿刺的需求。 ”
本新闻稿讨论了开发的药物的实验性用处,并不旨在转达关于有效性或安全性的结论。无法保证此类实验性药物将胜利完成临床开发或获得卫生主管部门同意。
[编者注]
1.关于Lecanemab(BAN2401)
Lecanemab是一种拟用于治疗阿尔茨海默病(AD)的实验性人源化单克隆抗体,是卫材和BioArctic的合作研发成果。Lecanemab可选择性联合中和并打消可溶性、毒性β(Aβ)淀粉样蛋白凑集体(原纤维),这些凑集体被以为加速了AD的神经体系变性过程。因此,Lecanemab可能对疾病病理机制发生影响,并延缓疾病进展。就治疗18个月时预先指定的剖析成果而言,研讨201表明,早期AD受试者的脑Aβ蓄积减少(P<0.0001),ADCOMS*测得的疾病进展减缓(P<0.05)。该研讨在治疗12个月时未到达重要结局指标**。在核心阶段和治疗间隔期(平均24个月)后启动研讨201的开放期延续实验,以评价安全性和有效性,该阶段目前正在进行中。
依据2007年12月与BioArctic签署的协定,卫材获得了Lecanemab用于治疗AD的全球研讨、开发、生产和上市权力。2014年3月,卫材和渤健签署了Lecanemab的结合开发和商业化协定,双方于2017年10月修订了该协定。目前,依据II期临床研讨(研讨201)的成果,正在进行症状性早期AD的Lecanemab要害性III期临床研讨(Clarity-AD)2020年7月,针对临床前AD个体(这些患者临床表示正常,但大脑中淀粉样蛋白程度为中等或偏高)启动了III期临床研讨(AHEAD 3-45)。以美国国立卫生研讨院分部国立老龄化研讨所资助的阿尔茨海默病临床实验联盟(该联盟为美国阿尔茨海默病和相干痴呆症的学术临床实验提供基本设施)和卫材与渤健之间的公私合作模式进行AHEAD 3-45研讨。
*由卫材开发的ADCOMS(AD综合评分)联合了ADAS-Cog(阿尔茨海默病评估计表-认知分量表)、CDR(临床痴呆评定量表)和MMSE(简易精力状况检讨表)量表的项目,以便敏锐地检测早期AD症状的临床功能变化和记忆变化。
**与抚慰剂相比,ADCOMS测得的治疗12个月时临床衰退较基线减缓≥25%的估量概率≥80%。
2.卫材与渤健在阿尔茨海默病方面的合作
卫材和渤健在AD治疗药物的开发和商业化方面进行了合作。卫材是Lecanemab结合开发的牵头人。
3.卫材与BioArctic在阿尔茨海默病方面的合作
自2005年以来,BioArctic与卫材就AD治疗药物的开发和商业化进行了长期合作。2007年12月签订了Lecanemab抗体的商业化协定,2015年5月签订了AD抗体Lecanemab备份的开发和商业化协定。卫材负责AD产品的临床开发、上市申请和商业化。BioArctic不承担用于AD的lecanemab的开发成本。
4.关于阿尔茨海默病临床实验联盟(ACTC)和AHEAD 3-45实验
由美国国立卫生研讨院国立老龄化研讨所(拨款编号U24AG057437)资助的ACTC为阿尔茨海默病和相干痴呆的学术临床实验提供基本设施。该联盟由南加州大学、哈佛大学和梅奥诊所组成,包含支撑临床实验设计、生物统计、信息学、医疗安全、监管监视、招募、临床运营、数据管理、研讨中心监测、一个生物标记物试验室和存储库以及神经影像学范畴的专家单位。ACTC包含全美35家重要临床研讨中心。
AHEAD 3-45是一项由ACTC、卫材和渤健以公私合作模式开展的III期临床研讨。
5.关于卫材株式会社
卫材株式会社是一家总部位于日本的领先全球制药公司。卫材株式会社的企业理念基于关怀人类健康(hhc)理念,即将患者及家眷的好处放在首位,为晋升其福祉做出贡献。公司凭借研发机构、生产基地和营销子公司的全球网络,致力于通过针对医疗需求未得到充足满足的靶病灶提供创新产品,尤其着重于神经学和肿瘤学战略范畴,实现公司的hhc理念。
卫材筹划应用从阿尔茨海默病治疗药物研发和上市中获得的经验,树立“卫材痴呆平台”。卫材筹划通过该平台构建“痴呆生态体系”,与医疗机构、诊断开发公司、研讨组织和生物风险投资公司等合作伙伴以及私人保险机构、金融业、健身俱乐部、汽车制作商、零售商和护理机构等合作伙伴合作,为痴呆患者及其家庭带来新的福祉。
6.关于卫材美国
在卫材美国,关怀人类健康(hhc)是我们的目的。我们将患者及家眷的好处放在首位,为晋升其福祉做出贡献。作为总部位于东京的卫材株式会社的美国子公司,我们关爱患者,这驱使我们尽力发现和开发创新疗法以赞助解决未满足的医疗需求。卫材是一家全面整合的制药企业,业务涉及肿瘤学和神经病学(痴呆相干疾病和神经退行性疾病)这两大全球业务板块。我们的美国总部、商业和临床开发组织位于新泽西州;摸索试验室位于马萨诸塞州和宾夕法尼亚州;全球需求链组织位于马里兰州和北卡罗来纳州。
7.关于渤健
作为神经科学的先锋,渤健为全球罹患严重神经疾病的患者探寻、研发和提供创新疗法。渤健是Charles Weissmann、Heinz Schaller、Sir Kenneth Murray与诺贝尔奖获得者Walter Gilbert和Phillip Sharp携手在1978年成立的全球首批生物科技公司之一。如今,渤健拥有治疗多发性硬化症的领先药物组合,推出了首个获批用于治疗脊髓性肌萎缩症的药物,并正在提供首个也是唯一获批用于阿尔茨海默病明白病理学特性的治疗方式。
渤健还在进行生物相似药商业化,并致力于推动神经科学范畴行业的最多样化渠道,这将转变具有高度未满足的医疗需求的若干范畴患者的尺度治疗。
2020年,渤健发起了一项为期20年、耗资2.5亿美元的大胆倡议,旨在解决气候、健康和公正等亲密相干的问题。Healthy Climate, Healthy Lives™旨在打消公司运营中的化石燃料,并与知名机构树立合作关系,以推动科学提高、改善人类健康成果,并为医疗程度低下的社区提供支撑。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20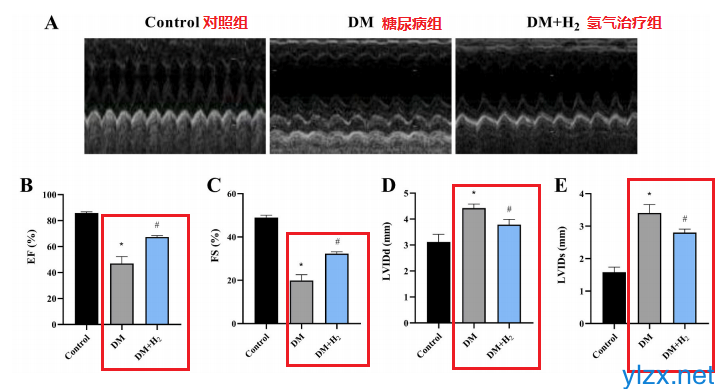
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20