卫材株式会社(总部:东京,CEO:内藤晴夫,以下简称“卫材”)和渤健公司(Nasdaq:BIIB,公司总部:马萨诸塞州剑桥市,CEO:Michel Vounatsos,以下简称“渤健”)发布,卫材在迅速审批通道下已完成向美国食品药品监视管理局(FDA)滚动提交生物制品许可申请(BLA),lecanemab 是一种用于研讨性药物抗β淀粉样蛋白(Aβ)原纤维抗体(BAN2401),用于治疗阿尔茨海默病(AD)引起的轻度认知障碍(MCI)和轻度AD(统称为早期AD),确认大脑中存在淀粉样病变。对于已完成的滚动提交部分,卫材已要求优先审查。如果FDA接受BLA,将设定《处方药使用者付费法案》(PDUFA)的行为日期(完成检讨的目的日期)。目前卫材在迅速审批通道下提交 lecanemab,但针对1,795名患者进行的 lecanemab III期确认性 Clarity AD 临床实验成果将于 2022 年秋季进行对外报告。FDA 已批准在完成后 Clarity AD 的成果可作为验证性研讨来验证 lecanemab 的临床获益。依据 Clarity AD 临床实验的成果,卫材可能会在 2022 财年向 FDA 提交 lecanemab 的全面同意申请。
卫材株式会社 CEO 内藤晴夫表现,“我们要感激早期 AD 患者和参与 lecanemab 201 研讨的医疗专业人士的合作,使这项 BLA 能够向美国 FDA 完成。阿尔茨海默病是一种进行性和损坏性的疾病,几乎没有治疗选择。卫材员工与阿尔茨海默病患者及其家眷共度时间,期待真正地了解他们的感受和挑战,多年来一直致力于发明新的治疗方式。我们沿着阿尔茨海默病持续体的综合药物发明方式反映了卫材的长期许诺,即为急需新治疗选择的 AD 患者、他们的家人和医疗保健专业人员提供创新治疗选择。”
渤健 CEO Michel Vounatsos 表现,“对于阿尔茨海默病,患者及其亲人没有足够的时光。这个范畴存在宏大的未满足需求,我们将继续在为患有这种毁灭性疾病的人提供更多治疗选择方面取得进展。抗淀粉样蛋白抗体是一种新的主要药物,它可认为患者及其医生提供更多选择,来解决这种庞杂疾病。”
Lecanemab 分离于 2021 年 6 月和 2021 年 12 月获得 FDA 的突破性治疗和迅速通道指定。2022 年 3 月,卫材,在日本的事前评估咨询制度下,开端向药品和医疗器械局(PMDA)提交申请数据,以期待获得 lecanemab 早期同意,并将依据卫材 2022 财年 Clarity AD 的成果,申请生产和上市许可。
卫材在全球规模内引导 lecanemab 的开发和监管提交,卫材和渤健共同商业化和共同推广该产品,卫材拥有最终决策权。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20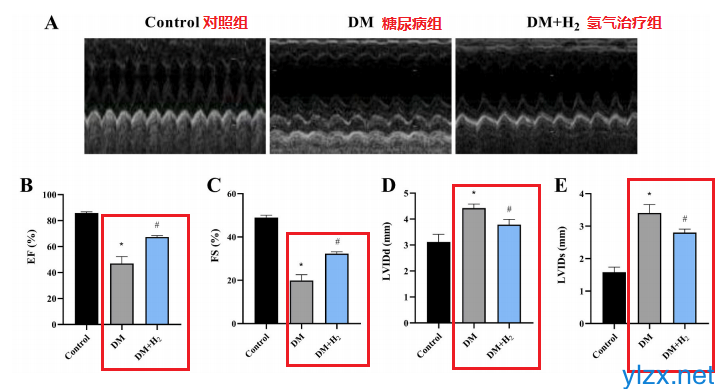
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20