再鼎医药(纳斯达克股票代码:ZLAB;香港联交所股票代码:9688),一家以患者为中心的、处于商业化阶段的创新型全球生物制药公司,今天颁布了2022年第一季度的财务事迹,以及近期产品亮点和公司进展。
再鼎医药创始人、董事长兼首席执行官杜莹博士表现:"凭借日益坚实的基本和一以贯之的执行力,再鼎第一季度的事迹和产品组合取得了全面进展。继去年我们的抗IL-17A Humabody® ZL-1102治疗慢性斑块状银屑病取得概念验证结果之后,再鼎医药最近在2022年AACR年会上颁布了四个要害肿瘤项目标临床前数据。我们不断加大内部研发和转化研讨,越来越多的管线开端进入临床研讨和概念验证,并有望在2022年获得多项要害临床研讨成果,与再鼎处于临床后期的管线形成有益弥补。"
"公司于今年年初肯定了2022年的战略重点,旨在将再鼎医药打造成新一轮生物制药创新浪潮的领军者。我非常愉快我们正坚定不移的朝着每一个战略重点前进,这其中包含筹划在2022年年中在中国内地提交efgartigimod的新药上市申请,在大中华区启动bemarituzumab治疗一线胃癌的注册性研讨,在2022年第三季度颁布KarXT 3期临床研讨EMERGENT-2的重要数据,并在研发上连续投入,以推动包含ZL-1102在内的拥有全球权力的专有管线到全球开发阶段。"
"更为主要的是,我们的商业化团队连续推进四个已上市产品的出售增加。尽管面临外部形势诸多挑战,但我们依然对业务充斥信念。这源于我们不断强大的引导团队和遍布全球的人才队伍,源于我们为全球资本市场可及性采用的一系列举动,更源于我们为了让创新药物惠及中国及全球患者,不断发明的一个又一个记载。这些都是再鼎价值的基础驱动力。展望未来,再鼎医药将继续致力于实现我们改善全球人类健康的总体愿景,并成为一家全球领先的生物制药公司。"
近期产品亮点及预期里程碑
肿瘤范畴
则乐®(尼拉帕利)
则乐是一种口服、每日一次的小分子聚ADP -- 核糖(PARP)1/2克制剂,是唯一在美国、欧盟地域和中国获批的无论患者生物标志物状况如何,均可单药用于晚期卵巢癌治疗的PARP克制剂。
近期产品亮点:
2022年3月,再鼎医药在美国妇科肿瘤学(SGO)年会上颁布了则乐作为维持治疗的3期临床研讨PRIME的阳性成果。在PRIME研讨中,与抚慰剂相比,接受尼拉帕利治疗明显延伸了患者的中位无进展生存期(mPFS):24.8个月对8.3个月,风险比(HR)为0.45;p<0.001。其他预设疗效成果包含:
在gBRCA突变患者中:尼拉帕利mPFS尚未到达,对照抚慰剂组10.8个月;HR,95% CI:0.40 (0.23,0.68)。
在无gBRCA突变患者中:尼拉帕利mPFS 19.3个月,对照抚慰剂组8.3个月;HR,95% CI:0.48(0.34,0.67)。
总体生存(OS)数据尚未成熟(尼拉帕利组和抚慰剂组的死亡率分离为14.5%和21.7%);在数据截止时,尼拉帕利治疗组显示出更优的趋势。
肿瘤电场治疗
肿瘤电场治疗是一种干扰肿瘤细胞分裂的治疗疗法。爱普盾和Optune Lua是已在一些国度和地域同意或上市用于治疗新诊断及复发胶质母细胞瘤及恶性胸膜间皮瘤的肿瘤电场治疗装备。
近期产品亮点:
2022年3月,再鼎医药合作伙伴Novocure发布佛罗里达大学麦克奈特脑科研讨所神经肿瘤科主任David Tran博士颁布了其研讨者发起的2期临床研讨2-THE-TOP的最新结果。该研讨旨在评估肿瘤电场治疗结合帕博利珠单抗和替莫唑胺治疗新诊断成人胶质母细胞瘤(GBM)患者的安全性和初步有效性。这是基于中位随访时光16.8个月后的初步成果,比拟了正在开展的2-THE-TOP研讨中26例患者。对于2-THE-TOP实验中的患者:
中位无进展生存期为12.1个月,而EF-14的匹配对比组患者的中位无进展生存期为7.9个月(风险比=0.46,p=0.033)。
中位总生存期为25.2个月,而EF-14的匹配对比组患者的中位总生存期为15.9个月(风险比=0.38,p=0.020)。
在2-THE-TOP研讨的15例目的病灶可测量患者中,6例(40%)获得部分至全体缓解,8例(53%)病情稳固。
2022年3月,再鼎医药合作伙伴Novocure颁布了一项评估肿瘤电场治疗结合紫杉醇治疗铂耐药卵巢癌安全性及有效性的3期要害性临床研讨INNOVATE-3的中期剖析成果。独立数据监察委员会(DMC)对所有入组的铂耐药卵巢癌患者进行了安全性数据审核。根据预先设定的中期剖析成果,INNOVATE-3研讨将按筹划进行最终剖析。在经过18个月随访后,数据将于2023年进行审查。
截至2022年3月31日,自2020年第3季度在中国内地商业化上市以来,爱普盾已被列入37个省级或市级政府指点的区域定制商业健康保险筹划(或弥补保险筹划)。
2022年预期里程碑:
预计于2022年年底颁布3期要害研讨LUNAR的重要数据,该研讨评估肿瘤电场治疗结合医生选择的免疫检讨点克制剂或多西他赛治疗4期非小细胞肺癌患者的疗效。
预计完成3期要害临床研讨METIS最后一位患者入组,该研讨旨在评估立体定向放射结合肿瘤电场治疗对照立体定向放射治疗非小细胞肺癌脑转移患者的疗效和安全性。
于2022年颁布胃癌2期先导研讨EF-31的重要数据,该研讨评估肿瘤电场治疗结合化疗治疗胃癌的安全性和有效性。
擎乐®(瑞派替尼)
擎乐是一款开关掌握酪氨酸激酶克制剂,经设计以普遍克制突变的KIT及PDGFRα激酶,是目前唯一在美国和中国获批用于治疗所有曾接受过三种或以上激酶克制剂治疗的晚期胃肠间质瘤(GIST)患者的疗法。
近期产品亮点:
截至2022年3月31日,自2021年5月在中国内地商业上市以来擎乐已被列入58个弥补保险筹划。
Adagrasib
Adagrasib是一款高选择性的强效口服小分子KRASG12C克制剂,用于治疗KRASG12C突变的非小细胞肺癌、结直肠癌(CRC)、胰腺癌和其他实体瘤。
2022年预期里程碑:
完成Mirati Therapeutics, Inc. (Mirati)针对NSCLC和CRC的全球潜在注册性研讨的大中华区首例患者入组。
在即将召开的2022年美国临床肿瘤学会(ASCO)年会上,将进行两项口头报告,报告将包含2期注册性研讨KRYSTAL-1的完全成果,该研讨旨在评估adagrasib用于经治的具有KRASG12C突变的NSCLC患者,以及adagrasib用于具有KRASG12C突变且伴有运动性未经治疗的中枢神经体系转移的NSCLC患者的数据。
2022年下半年,将更新adagrasib与帕博利珠单抗结合用于一线KRASG12C突变的NSCLC治疗的2期研讨KRYSTAL-7的耐受性和ORR数据。
2022年下半年进一步明白adagrasib单药一线治疗KRASG12C突变的NSCLC的注册路径,以及针对NSCLC以外的瘤种的下一步筹划。
Adagrasib有望获得FDA同意并商业化上市,用于治疗曾经接受过至少一次体系性治疗的KRASG12C突变的非小细胞肺癌患者;处方药用户付费法案(PDUFA)的目的行为日期为2022年12月14日。
Bemarituzumab
Bemarituzumab是一款潜在的同类开创抗体,作为针对FGFR2b过度表达的肿瘤靶向疗法,正在进行针对胃癌及胃食管接壤部(GEJ)癌的开发。
近期产品亮点:
再鼎医药合作伙伴安进已经启动了一项bemarituzumab结合口服化疗方案针对FGFR2b过度表达的一线胃癌的1b期研讨(FORTITUDE-103)。
再鼎医药合作伙伴安进正在进行bemarituzumab结合多西他赛结合治疗FGFR2b过度表达鳞状NSCLC的1b期研讨(FORTITUDE-201)的患者招募。
2022年预期里程碑:
于2022年第四季度在大中华区启动一项评估bemarituzumab用于一线晚期胃癌和GEJ癌的注册性研讨。
正筹划针对其他实体瘤开展摸索研讨。
Odronextamab
Odronextamab是一款双特异性抗体,旨在通过衔接并活化细胞毒性T细胞(与CD3联合)及淋巴瘤细胞(与CD20联合),触发抗肿瘤作用。
近期产品亮点:
再鼎医药合作伙伴再生元发布,FDA对odronextamab用于滤泡性淋巴瘤(FL)和弥漫性大B细胞淋巴瘤(DLBCL)授予迅速通道认定。
2022年预期里程碑:
完成B-NHL潜在要害2期研讨的入组。
在2022年下半年颁布用于B-NHL的潜在要害2期研讨的进一步成果,并向FDA提交生物制品许可申请(BLA)。
于2022年启动皮下剂型的研讨给药、3期OLYMPIA项目,以及与其他药物联用的研讨。
Repotrectinib
Repotrectinib是新一代酪氨酸激酶克制剂(TKI),能有效靶向作用于ROS1及TRKA/B/C,对既往未接受过TKI治疗或TKI经治的患者均有治疗潜力。
近期产品亮点:
2022年4月,再鼎医药及Turning Point Therapeutics, Inc. (Turning Point)颁布了此前经盲态独立中心影像(BICR)确认颁布的1/2期TRIDENT-1研讨中中国亚组人群的阳性重要数据。
在TKI初治的中国患者队列中(EXP-1:n=11) ,确认的客观缓解率(cORR)为91%(95%CI:59,100)。
在TKI经治的中国患者中,接受过1次TKI和含铂化疗治疗的患者的cORR为67%(EXP-2:n=3);在全球临床研讨中,接受两次TKI 治疗的患者的cORR为50%(EXP-3:n=4);接受1次TKI治疗的患者的cORR为36%(EXP-4:n=11)。
2022年4月,经BICR确认,再鼎医药合作伙伴Turning Point颁布了注册性研讨TRIDENT-1的阳性重要成果,该成果涵盖了所有四个ROS1阳性晚期NSCLC患者队列。
在TKI初治的患者人群中(EXP-1:n = 71),cORR为79%(95% CI:68,88)。
在TKI经治患者中,接受1次TKI和含铂化疗的患者的cORR为42%(EXP-2:n=26);接受两次TKI治疗的患者的cORR为28%(EXP-3:n=18);接受1次TKI治疗的患者的cORR为36%(EXP-4:n=56)。
在TKI经治且已肯定ROS1 G2032R溶剂前沿突变的患者中,cORR为59%(n=10/17;95%CI:33,82)。
2022年3月,再鼎医药合作伙伴Turning Point发布,该公司已完成1/2期注册性临床研讨TRIDENT-1的EXP-6亚组的40名患者入组目的。 EXP-6由NTRK阳性TKI经治的晚期实体瘤患者组成。
2022年预期里程碑:
完成1/2期注册性临床研讨TRIDENT-1的患者入组。
在2022年第四季度提交上市申请前的会议上与国度药品监视管理局(NMPA)进行注册方面的讨论。
于2022年第二季度的NDA递交前会议上与FDA讨论基于BICR的重要数据。
预计在2022年下半年即将召开的医学会议上,详细更新经BICR剖析的TRIDENT-1的研讨成果,包含颅内运动的研讨成果。
于2022年下半年提供TRIDENT-1研讨中NTRK阳性晚期实体瘤队列的临床数据更新。
CLN-081
CLN-081是一款口服、不可逆表皮生长因子受体(EGFR)克制剂,可以选择性地靶向作用于EGFR外显子20插入突变,同时避过野生型EGFR细胞。
近期产品亮点:
2022年3月,再鼎医药合作伙伴Cullinan Oncology发布了CLN-081在NSCLC EGFR外显子20插入突变患者中的临床研讨和注册事务最新进展。其中正在进行的1/2a期研讨中一日两次100mg剂量程度的重要亮点包含:
在39名可评估呈现缓解的患者中,16名确认部分缓解,cORR为41% 。
没有患者呈现过3级或更严重的治疗相干的腹泻或皮疹。
先前在初始1期患者亚组(n=13)中视察到有潜力的连续缓解,预估中位连续缓解时光>15个月,mPFS为12个月。
2022年预期里程碑:
非小细胞肺癌2a期潜在要害临床研讨完成大中华区首例患者入组。
CLN-081更新数据入选ASCO 2022年年会口头报告。
在完成食物影响药代动力学(PK)研讨后,于2022年下半年启动要害研讨。
Elzovantinib (TPX-0022)
Elzovantinib是一款口服多靶点激酶克制剂,具有新型三维大环构造,可克制MET 、CSF1R(集落刺激因子1受体)及SRC激酶。
2022年预期里程碑:
全球1/2期临床研讨SHIELD-1的一阶段扩大部分完成大中华区首位患者入组。
于2022年下半年提供SHIELD-1 1期研讨的临床数据更新。
视FDA对中等剂量程度数据的反馈而定,于2022年下半年启动SHIELD-1临床研讨的2期部分。
于2022年年中启动elzovantinib和阿美替尼结合用药的1b/2期临床研讨SHIELD-2。
Retifanlimab
Retifanlimab是一款处于研讨阶段的可克制PD-1的单克隆抗体。
近期产品进展:
基于临床数据和不断变化的治疗远景,我们决议完成并关闭retifanlimab用于MSI-H/dMMR子宫内膜癌在大中华区的临床研讨患者入组。
2022年预期里程碑:
完成全球3期POD1UM-304临床研讨的患者入组,以评估retifanlimab结合含铂化疗治疗一线转移性NSCLC患者。
BLU-945
BLU-945是一款选择性、强效的EGFR克制剂,可以克制L858R活化突变或19外显子缺失突变伴有获得性T790M和C797S突变,这些突变分离是第一代EGFR克制剂和奥希替尼常见的靶内耐药突变。BLU-945有望用于治疗EGFR驱动的非小细胞肺癌。
近期产品亮点:
2022年4月,再鼎医药合作伙伴Blueprint Medicines Corporation在2022年美国癌症研讨协会(AACR)年会上颁布了BLU-945在EGFR驱动的晚期NSCLC患者中的1/2期临床研讨SYMPHONY的概念验证数据。初步研讨成果显示出与临床前数据一致的安全性和临床活性的早期证据,可支撑扩大BLU-945与包含奥希替尼在内的多种药物联用的临床开发。
Blueprint Medicines在目前进行的1/2期临床研讨SYMPHONY中启动了一个队列,以评估BLU-945与奥希替尼联用,用于二线或更后线治疗EGFR突变的NSCLC患者。
2022年预期里程碑:
于2022年下半年颁布1/2期临床研讨SYMPHONY中BLU-945与奥希替尼联用的剂量递增队列的初步临床数据。
在BLU-945的1/2期临床研讨SYMPHONY中启动更多队列,包含在前线治疗等多个患者人群中与其他药物的结合治疗。
BLU-701
BLU-701是一款选择性、强效的EGFR克制剂,可以克制L858R活化突变或19外显子缺失突变伴有获得性C797S突变,这些突变是奥希替尼常见的靶内耐药突变。BLU-701有望用于治疗EGFR驱动的非小细胞肺癌。
近期产品亮点:
2022年4月,再鼎医药合作伙伴Blueprint Medicines在美国癌症研讨协会(AACR)年会上颁布了临床前数据。该数据显示,BLU-945和BLU-701在EGFR L858R驱动伴有或不伴有靶内耐药突变的NSCLC肿瘤模型中具有强效的抗肿瘤活性,支撑两药结合在一线和二线EGFR驱动的NSCLC中的研讨。
2022年预期里程碑:
于2022年下半年颁布BLU-701治疗EGFR驱动非小细胞肺癌1/2期临床研讨HARMONY的初步数据。
内部肿瘤研发项目
近期亮点:
2022年4月,再鼎医药在2022年美国癌症研讨协会(AACR)年会上展现了其肿瘤范畴的内部研发产品的新数据。
以口头报告首次颁布了ZL-1218的相干临床前数据。ZL-1218是一种抗CCR8抗体。
以海报情势展现了ZL-1201,一款针对晚期恶性血液肿瘤和实体肿瘤的抗CD47抗体;ZL-1211,一款用于胃癌和胰腺癌的抗CLDN18.2抗体;ZL-2201,一款用于实体瘤的DNA-PK克制剂。
Simurosertib, ZL-2309(CDC7克制剂,全球权力)
Simurosertib(又称为ZL-2309)是一款潜在同类开创的口服、选择性CDC7克制剂。CDC7是一种蛋白激酶,在DNA复制和绕过DNA损伤反响中起要害作用。
2022年预期里程碑:
于2022年第二季度启动2期概念验证临床研讨。
ZL-1201 (CD47 克制剂,全球权力)
ZL-1201是一款经工程化改革降低了效应功能,特异性靶向CD47的人源化IgG4单克隆抗体。ZL-1201单药和结合治疗的治疗潜力,将在实体瘤和恶性血液肿瘤中进行评估。
2022年预期里程碑:
正在进行的1期临床研讨将于2022年年中肯定2期推举剂量。
自身免疫疾病范畴
VYVGART™(Efgartigimod)
Efgartigimod是一款抗体片断,旨在减少致病性免疫球蛋白G(IgG)自身抗体并阻断IgG循环应用进程。其与新生儿Fc受体(FcRn)联合,该受体在全身都有普遍表达,在阻拦IgG降解的进程中施展着核心作用。
近期产品亮点:
2022年5月,再鼎医药合作伙伴argenx颁布了efgartigimod用于治疗原发免疫性血小板减少症(ITP)的3期ADVANCE研讨的重要阳性成果。ADVANCE研讨到达了其重要终点,与抚慰剂(2/40;5%)相比,接受efgartigimod治疗的患者血小板连续应答的比例更高(17/78;21.8%),实现了血小板的连续应答(p=0.0316)。血小板衍生要害次要终点也显示出统计学意义。
2022 年4 月,再鼎医药合作伙伴argenx颁布了正在进行的3期ADAPT+研讨的中期成果。这是一项开放标签的扩大研讨,旨在评估efgartigimod治疗全身型重症肌无力(gMG)成人患者的长期有效性、安全性及耐受性。中期数据显示的efgartigimod在多个治疗周期带来的连续改善和安全性,和3期ADAPT研讨一致。
2022年3月,再鼎医药合作伙伴argenx颁布了efgartigimod皮下注射治疗gMG的3期临床研讨ADAPT-SC的重要阳性成果数据。Efgartigimod皮下注射治疗到达了重要研讨终点,在第29天总IgG从基线程度降低,证实了与efgartigimod静脉注射制剂在gMG患者中相比具有统计学上的非劣效性。
2022年预期里程碑:
于2022年年中向国度药监局递交用于gMG的新药上市申请。
于2022年启动针对两种自身免疫性肾病的概念验证研讨。
与argenx合作摸索和推动其他适应证的研讨。
于2022年第二季度启动针对特发性炎性肌病(肌炎)的三种亚型,包含免疫介导坏死性肌病、抗合成酶综合征和皮肌炎的注册性研讨ALKIVIA;筹划针对每种亚型的前30名患者的数据进行中期剖析。
于2022年年底向FDA递交efgartigimod皮下注射剂型治疗gMG的新药上市申请。
ZL-1102(IL-17全人源VH抗体片断,全球权力)
ZL-1102是一款新型全人源VH抗体片断(Humabody®) ,靶向作用于IL-17A细胞因子,具有高亲和力和活性。有别于其他抗IL-17产品,ZL-1102正在开发用于轻中度慢性斑块状银屑病(CPP)的局部治疗。
2022年预期里程碑:
于2022年下半年启动CPP的全球2期研讨。
抗沾染范畴
纽再乐®(甲苯磺酸奥马环素)
纽再乐是一款每日一次口服或静脉使用的抗生素,用于治疗小区获得性细菌性肺炎(CABP)及急性细菌性皮肤和皮肤构造沾染(ABSSSI)的成人患者。再鼎医药负责其在中国的开发,并于2021年12月获得NMPA上市同意。
2022年预期里程碑:
争夺将纽再乐CABP和ABSSSI适应证纳入国度医保目录。
于2022年下半年提交再鼎医药上市后研讨筹划。
舒巴坦-Durlobactam
(SUL-DUR,亚太地域权益)
舒巴坦-Durlobactam是一款β—内酰胺/β—内酰胺酶克制剂的组合型新药,对于包含碳青霉烯类耐药菌株在内的鲍曼不动杆菌具有奇特抗菌活性。
近期产品亮点:
2022年4月,再鼎医药合作伙伴Entasis Therapeutics在里斯本举办的第32届欧洲临床微生物学和传染病大会(ECCMID)年会上展现了要害3期ATTACK研讨的重要数据。
2022年预期里程碑:
于2022年第四季度向NMPA提交新药上市申请。
于2022年年中向FDA提交新药上市申请。
中枢神经体系范畴
KarXT
KarXT将新型毒蕈碱冲动剂呫诺美林与已获批的毒蕈碱拮抗剂曲司氯铵联合。2021年11月,再鼎医药与Karuna合作在大中华区开发KarXT用于治疗精力分裂症和其他适应证,如痴呆相干的精力病性障碍。
2022年预期里程碑:
于2022年中与NMPA就精力分裂症在中国注册相干事项进行沟通。
启动桥接研讨。
2022年预期里程碑:
于2022年第二季度完成3期EMERGENT-2研讨的入组,并于2022年第三季度报告该研讨的重要数据。
于2022年年中启动针对评估KarXT治疗阿尔茨海默症精力病性障碍的3期研讨,并于2022年上半年颁布详情。
公司最新动态
2022年4月,再鼎医药发布,公司董事会审计委员会已同意聘任毕马威会计师事务所(KPMG)为公司的独立注册会计师事务所。毕马威将负责就截至2022年12月31日止财年向美国证券交易委员会(SEC)提交的再鼎医药年度合并财务报表和财务报告内部掌握进行审计。再鼎医药期待,此次聘任毕马威这样一家位于美国境内、并接受美国公众公司会计监察委员会检讨的审计事务所,将赞助公司遵照《外国公司问责法案》规定的审计要求,并且在此前提下有助于公司继续在纳斯达克挂牌上市。
2022年3月,再鼎医药股东同意了“1拆10”的股份拆细提案,于2022年3月30日生效。此次“1拆10”的股份拆细将增长已发行普通股数量,并降低每股普通股的面值及交易价钱。公司董事会以为,此举将进步普通股的交易流动性,降低投资门坎,从而吸引更多投资者买卖普通股。股份拆细不会导致公司已发行在外的美国存托股份(ADS)数目产生任何变化。
再鼎医药不断增强和强大团队。2022年3月,再鼎医药发布任命Josh Smiley为首席运营官(COO),该任命将于2022年8月生效。Smiley先生拥有超过26年的生物制药行业工作经验,包含曾在礼来公司(Lilly)负责财务、公司战略、业务拓展、风险投资和全球业务服务运营。
截至2022年3月31日,再鼎医药共有1,999名全职员工,其中从事研发和商业化岗位的员工数目分离为825人和950人。
2022年第一季度财务事迹
截至2022年3月31日止三个月,总收入为4,670万美元,2021年同期收入为2,010万美元。其中包含则乐产品出售收入2,960万美元(2021年同期为1,260万美元)、爱普盾产品出售收入1,280万美元(2021年同期为710万美元)、擎乐产品出售收入300万美元(2021年同期为40万美元)、纽再乐产品出售收入70万美元(2021年同期无收入)。
截至2022年3月31日止三个月,研讨与开发(研发)支出为5,390万美元,2021年同期为2.039亿美元。研发支出的降低重要由于没有新的授权引进预付款,部分被正在进行及新启动的后期临床研讨的相干费用、增聘研发人员的工资及工资相干开支抵销。不计入新的授权引进预付款,截至2022年3月31日止三个月,核心研发支出为5,390万美元,2021年同期为4,160万美元。
截至2022年3月31日止三个月,出售、一般及行政开支(SG&A)为5,700万美元,2021年同期为3,580万美元。这一增加重要是由于商业、一般行政人员增长导致的工资和工资相干费用增长,由于再鼎医药继续扩展和投资其在中国的商业化运营,预计未来几年收入大幅增加。
截至2022年3月31日止三个月,再鼎医药亏损净额为8,240万美元,2021年同期的亏损净额为2.329亿美元。亏损净额的减少重要由于没有新的授权引进预付款。截至2022年3月31日止三个月,每股普通股净亏损为0.09美元,而2021年同期为0.26美元。截至2022年3月31日止三个月,每股ADS净亏损为0.86美元,而2021年同期为2.64美元。
截至2022年3月31日,现金及现金等价物、短期投资及受限制现金合计为13.13亿美元,而截至2021年12月31日则为14.099亿美元。
关于再鼎医药
再鼎医药(纳斯达克股票代码:ZLAB;香港联交所股票代码:9688)是一家以患者为中心的、处于商业化阶段的创新型全球生物制药公司,致力于通过创新疗法的开发和商业化解决肿瘤、自身免疫、沾染性疾病和中枢神经体系范畴未被满足的医疗需求。为到达这一目的,公司经验丰硕的团队已与全球领先的生物制药公司树立了战略合作,打造起由创新的已上市和候选产品组成的丰硕的产品管线。再鼎医药已树立起具有壮大药物研发和转化研讨才能的内部团队,正在打造拥有国际知识产权的候选药物管线。我们的愿景是成为一家领先的全球生物制药公司,研发、生产并出售创新产品,为增进全世界人类的健康福祉而尽力。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20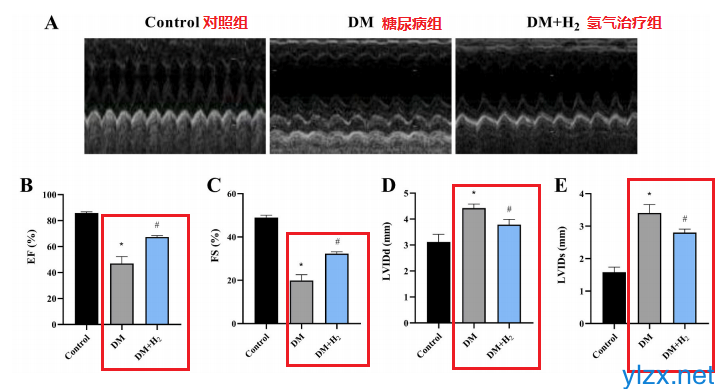
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20