"食力领先,拓启新生"
2022年6月25日,"食力领先,拓启新生"君实生物拓益®(特瑞普利单抗注射液)一线食管癌适应症全国上市会美满召开。本次上市会以广州为主会场,并在北京、郑州、成都、南京设分会场,通过五城连线互动,汇聚全国消化道肿瘤范畴专家,缭绕新兴免疫治疗在食管癌范畴的结果与远景展开学术分享与讨论,共同见证拓益®(特瑞普利单抗)"食管鳞癌OS17性命体系"的正式宣布!

拓益(R)一线食管癌适应症全国上市会美满召开本次大会邀请到中山大学肿瘤防治中心徐瑞华教授、北京大学临床肿瘤医院沈琳教授和中国医学科学院肿瘤医院深圳医院王绿化教授担任大会主席;中国医学科学院肿瘤医院李印教授、北京大学肿瘤医院陈克能教授、河南省肿瘤医院罗素霞教授、河南科技大学第一从属医院高社干教授、四川省肿瘤医院韩泳涛教授、空军军医大学唐都医院姜涛教授、江苏省肿瘤医院曹国春教授、上海胸科医院李志刚教授分离担任分会场主席。
"OS17性命体系"引领食管癌治疗新格式
2022年5月,由中国本土创新药企君实生物自主研发的抗PD-1单抗药物拓益®(特瑞普利单抗)结合紫杉醇和顺铂(TP化疗)用于不可切除局部晚期/复发或远处转移性食管鳞癌(ESCC)患者的一线治疗新适应症获得国度药品监视管理局(NMPA)同意。这项"中国方案"刷新了中国晚期食管鳞癌患者一线治疗的中位总生存期,将以超强"食力",为患者开启全新的性命体系!
大会主席徐瑞华教授表现:"作为我国自主研发的抗PD-1单抗,拓益®食管癌一线适应症的获批具有多重意义,这是新的突破、新的选择,为患者带来了新的愿望!同时,也是‘中国方案'对国际免疫治疗范畴的重大贡献!"
大会主席沈琳教授表现:"食管癌是一个比拟特别的肿瘤类型,全球规模内来看,我国事绝对的高发地域。而值得自豪的是,在这一范畴,中国创新药企业已经跟上了发达国度的脚步。愿望越来越多像君实生物这样的中国创新药企业能继续投入研发创新,开发出更多创新药物,改善我国癌症患者的生存!"
大会主席王绿化教授表现:"本次拓益®食管癌一线适应症的获批是中国食管癌治疗范畴一件非常值得庆祝的里程碑事件,标记着一个全新时期的到来,晚期食管癌的治疗格式将也被彻底转变,17个月的生存记载在中国势必也将成为标杆!"
长生存久获"益","中国方案"谱写未来可期
拓益®(特瑞普利单抗)一线食管癌适应症的获批重要基于一项随机、双盲、抚慰剂对比、多中心的III期临床实验(JUPITER-06研讨),由徐瑞华教授担任重要研讨者。该研讨在全国72家单位结合开展,共纳入514例既往未接受过对复发或转移肿瘤的体系性抗肿瘤治疗的晚期或转移性ESCC患者,创新性地采取更贴合本土临床实践的TP化疗方案与我国原研的PD-1克制剂特瑞普利单抗进行联用,取得了突破性的结果。
中山大学肿瘤防治中心王峰教授对JUPITER-06研讨进行了亮点解读,她表现:"晚期食管鳞癌患者一线尺度治疗多采取以铂类为基本的化疗方案,但临床获益有限,急切须要新的药物和治疗方案来延伸患者的生存期。而JUPITER-06研讨彻底打破了该范畴多年停滞不前的治疗格式。
研讨显示,与单纯化疗相比,特瑞普利单抗结合含铂化疗让更多晚期食管鳞癌患者获得了更好的生存获益,其中中位总生存期(mOS)大幅延伸至17个月,对照对比组单纯化疗延伸了6个月,疾病进展或死亡风险降低42%,且无论患者PD-L1表达如何,均可获益。在安全性方面,在化疗基本上参加特瑞普利单抗进行治疗,未发现新的安全性信号。"
值得一提的是,JUPITER-06的研讨结果还曾多次获得国际学术界的认可,包含获得国际顶尖肿瘤学杂志《Cancer Cell》(影响因子:31.743)发表,并以口头汇报情势荣登欧洲肿瘤内科学会年会(ESMO 2021)和癌症免疫治疗学会年会(SITC 2021),这是"中国方案"在国际学术舞台上的又一次出色出现。
此外,基于JUPITER-06研讨,"特瑞普利单抗+顺铂+紫杉醇"这一疗法还获得《2022年中国临床肿瘤学会(CSCO)食管癌诊疗指南》和《2022年CSCO免疫检讨点克制剂临床利用指南》"双"推举,将为中国晚期食管鳞癌患者带来更好的生存获益。
不忘初心 患者需求驱动前行力气
以往国际上以抗PD-1单抗为代表的免疫检讨点克制剂的适应症开发重要缭绕欧美主流病症,像食管癌这类亚洲高发瘤种的新药研发则相对迟缓。作为本土创新药企,君实生物积极携手中国专家学者,大胆摸索创新,不断拓宽免疫疗法在本土高发瘤种新适应症上的利用,旨在满足中国患者长期未被满足的临床需求。
君实生物联席首席执行官李聪先生表现:"我们很愉快拓益®能够在晚期食管鳞癌一线治疗范畴获批新适应症,为更普遍的患者带来我们的肿瘤免疫疗法,其中也包含过往对于免疫检讨点克制剂疗效有限的PD-L1低表达肿瘤患者。关于拓益®的创新还在谱写。我们前瞻性布局了多元化的研讨摸索,使拓益®在食管癌中的临床摸索进一步前移,是最早布局食管癌新辅助治疗的国产抗PD-1单抗之一,有望为中国乃至全球的食管癌患者带来更多获益!"
在海外市场方面,特瑞普利单抗用于治疗食管癌已获得美国食品药品监视管理局(FDA)授予的孤儿药资历认定(Orphan-drug Designation),有助于加快推动该药物在美国的临床实验及上市注册的进度。
君实生物全球研发总裁邹建军博士表现:"君实生物连续关注国人中高发,且临床急需治疗的瘤种。除了特瑞普利单抗,公司正在同步开发近40款基于新平台、新靶点的抗肿瘤新药,致力打造出具有协同互补效应的研发管线。我们非常期待继续与中国专家携手,为患者提供更多后果更好、消费更优的治疗选择,同时也为全球肿瘤治疗范畴贡献‘中国答案'和‘中国方案'。"
关于食管癌
食管癌是消化道范畴最常见的恶性肿瘤之一。据统计,2020年中国的食管癌新发病例数高达32万,死亡病例数到达30万,均占到全球的一半以上,发病率和死亡率分离位居国内所有恶性肿瘤中的第五和第四位[1][2]。食管鳞癌和腺癌是食管癌的两种重要组织学亚型,中国患者以食管鳞癌为重要亚型,约占总体发病率的90%[3]。对于晚期食管鳞癌患者,当前一线尺度治疗多采取以铂类为基本的化疗方案,但临床获益有限,5年总生存率不足20%,急切须要新的药物和治疗方案来延伸患者的生存期[4]。
关于特瑞普利单抗注射液(拓益®)
特瑞普利单抗注射液(拓益®)作为我国同意上市的首个国产以PD-1为靶点的单抗药物,获得国度科技重大专项项目支撑,并荣膺国度专利范畴最高奖项"中国专利金奖"。本品获批的第一个适应症为用于既往接受全身体系治疗失败的不可切除或转移性黑色素瘤的治疗。2020年12月,特瑞普利单抗首次通过国度医保会谈,目前已有3项适应症纳入《2021年药品目录》。2021年2月,特瑞普利单抗获得国度药品监视管理局(NMPA)同意,用于既往接受过二线及以上体系治疗失败的复发/转移性鼻咽癌患者的治疗。2021年4月,特瑞普利单抗获得NMPA同意,用于含铂化疗失败包含新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗。2021年11月,特瑞普利单抗结合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗的新适应症获得NMPA同意。2022年5月,特瑞普利单抗结合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗的新适应症获得NMPA同意。此外,特瑞普利单抗还获得了《中国临床肿瘤学会(CSCO)黑色素瘤诊疗指南》、《CSCO头颈部肿瘤诊疗指南》、《CSCO鼻咽癌诊疗指南》、《CSCO尿路上皮癌诊疗指南》、《CSCO食管癌诊疗指南》及《CSCO免疫检讨点克制剂临床利用指南》推举。
2021年3月,特瑞普利单抗用于晚期黏膜黑色素瘤的一线治疗被NMPA纳入突破性治疗药物程序。2021年12月,特瑞普利单抗结合尺度一线化疗用于未经治疗、驱动基因阴性的晚期非小细胞肺癌的新适应症上市申请获得NMPA受理。在国际化布局方面,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌范畴获得FDA授予2项突破性疗法认定、1项迅速通道认定、1项优先审评认定和5项孤儿药资历认定。
特瑞普利单抗自2016年初开端临床研发,至今已在全球开展了笼罩超过15个适应症的30多项临床研讨,积极摸索本品在黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、胆管癌、乳腺癌、肾癌等适应症的疗效和安全性,与国内外领先创新药企的结合疗法合作也在进行当中,期待让更多中国以及其它国度的患者获得国际先进程度的肿瘤免疫治疗。
关于君实生物
君实生物(688180.SH,1877.HK)成立于2012年12月,是一家以创新为驱动,致力于创新疗法的发现、开发和商业化的生物制药公司。公司具有由超过50项在研产品组成的丰硕的研发管线,笼罩五大治疗范畴,包含恶性肿瘤、自身免疫体系疾病、慢性代谢类疾病、神经体系类疾病以及沾染性疾病。
凭借蛋白质工程核心平台技术,君实生物身处国际大分子药物研发前沿,获得了首个国产抗PD-1单抗NMPA上市同意、国产抗PCSK9单抗NMPA临床申请同意、全球首个治疗肿瘤抗BTLA阻断抗体在中国NMPA和美国FDA的临床申请同意,目前正在中美两地开展多项Ib/II期临床实验。
自2020年疫情爆发之初,君实生物快速反响,与国内外科研机构及企业携手抗疫,应用技术积聚迅速开发了多款治疗COVID-19的创新药物,积极承担中国制药企业的社会责任。其中包含:国内首个进入临床阶段并参与全球抗疫的新冠病毒中和抗体埃特司韦单抗(JS016)于2021年在超过15个国度和地域获得紧迫使用授权,新型口服核苷类抗新冠病毒药物VV116(JT001)已进入国际多中心III期注册临床研讨阶段,以及其他多种类型药物,连续为全球抗疫贡献中国力气。
目前君实生物在全球拥有两千八百多名员工,散布在中国上海、苏州、北京和广州,以及美国旧金山和马里兰。

多样化、复合式流传,晋升本市医院和医
市健康增进委员会办公室、市卫生健康委组织上海市健康增进中心、复旦大学公共卫生学院在...(154)人阅读时间:2022-12-20
45个抗癌药品和19个罕见病药品参加第三批
为勉励制药产业发展,降低患者用药成本,2022年11月21日,财政部等部门结合宣布《关于宣...(198)人阅读时间:2022-12-20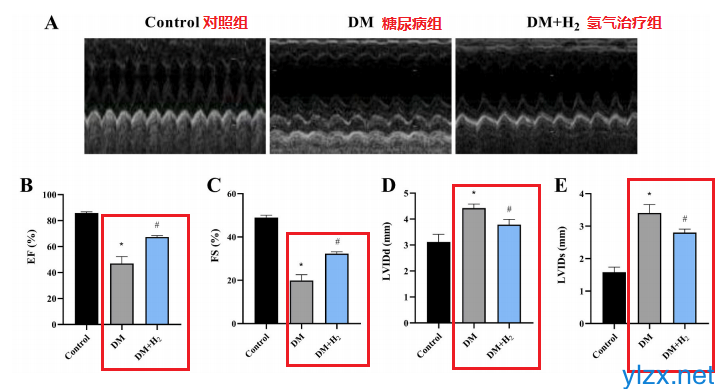
氢气结合药物对糖尿病及并发症(如糖尿
【背景介绍】糖尿病会引起多种并发症,在中老年人群中,糖尿病心脏病是糖尿病患者致死的...(241)人阅读时间:2022-12-20
第三批抗癌药品和罕见病药品可享增值税
记者21日从财政部了解到,为勉励制药产业发展,降低患者用药成本,财政部、海关总署、...(403)人阅读时间:2022-12-20
玛西普首次亮相CMEF,六大创新场景引领健
创新科技,智领未来,11月23日,第86届中国国际医疗器械博览会(CMEF)在深圳国际会展中心(宝安...(493)人阅读时间:2022-12-20